Bly-syre batteriet har været anvendt siden omkring 1880 og der er egentlig ikke sket nogen særlig udvikling siden da.
Vi skelner mellem start-, semitraction- og tractionbatterier. Forskellen ligger i opbygningen af elektroderne. En celle bygges op ved at de to elektroder opbygges af et bly-gitter - normalt en bly-antimon legering for at give større mekanisk styrke. Gitteret fyldes med en pasta af PbO i vand. Dette giver efter tørring et porøst materiale, hvilket betyder en stor overflade.
Et startbatteri har tynde, meget finmaskede plader, hvilket betyder at elektroderne henfalder hurtigt ved sulfatering på grund af ringe materialetykkelse (se senere). Derfor er startbatteriet velegnet til at give en høj strøm i et kort tidsrum, mens afladning hurtigt vil ødelægge den porøse belægning.
Jo grovere denne belægning er, desto længere levetid og desto lavere strøm kan trækkes.
Hernæst fyldes beholderen med en elektrolyt (svag svovlsyre) og batteriet lades op.
Strømmen får to processer til at ske
Positive pol
PbO + 2 H2O --------> PbO2 + 2 H+ + 2 e-
Negative pol
PbO + 2H+ + 2e- ---------> Pb + H2O
Så ved fuld opladning består den negative pol af rent bly og den positive af bly(IV)oxid.
Under afladning fås
Positive pol
PbO2 + 4 H+ + 2 e- + SO4-- ------> PbSO4 + 2H2O
Negative pol
Pb + SO4-- -----> PbSO4 + 2 e-
Det give en total reaktion på
PbO2 + Pb + 2 SO4-- + 4 H+ ----> 2 PbSO4 + 2 H2O
eller
PbO2 + Pb + 2 H2SO4 ----> 2 PbSO4 + 2 H2O
Ved opladning går reaktionen den anden vej så det vil være mere korrekt at skrive
PbO2 + Pb + 2 H2SO4 <====> 2 PbSO4 + 2 H2O
hvor processen går mod højre under afladning og mod venstre under opladning. Bemærk at Pb, PbO2 og PbSO4 er faste stoffer.
Sulfatering
Desværre vil ikke al blysulfat gendannes til bly og blyoxid. Blysulfat har en kedelig tendens til at krystallisere og krystallerne virker som katalysator for yderligere krystallisering. Og da sulfaten desuden har en mindre massefylde end både rent bly og blyoxid, fylder den mere og kan dermed ødelægge de porøse elektroder. Sulfaten er tungt opløselig i batterisyren (0.43ml/l) hvilket tillige betyder at den del af sulfaten, der drysser ned fra elektroderne, kun i ringe grad bliver gendannet. Materialet til bundfaldet kan kun komme fra elektroderne, hvilket betyder at de slides. Samtidig vil koncentrationen af H2SO4 mindskes. Dette betyder, at koncentrationen af H2SO4 udover at give et billede af ladetilstanden også giver et billede af hvor meget batteriet er slidt når det er fuldt opladet.
I nogle tilfælde kan man pine lidt ekstra ud af sine batterier ved at efterfylde med svovlsyre for at kompensere for syretabet ved henfald af elektroderne, men materialetabet i elektroderne kan der ikke kompenseres for.
De-sulfatering
Den ideelle situation er at addere et stof, der kan opløse sulfaten uden at deltage i processen. Det ville i princippet betyde at batteriet ikke ville slides selv om elektroderne efterhånden ville blive kraftigt deformerede.
Stoffet eksisterer faktisk og bliver rutinemæssigt tilsat fra fabrikkernes side. Der er mindre forskelle i de enkelte fabrikkers metoder for at sinke sulfateringen.
En anden mulighed er at 'knuse' sulfatkrystallerne. Dette gendanner overfladerne på elektroderne og den overskydende sulfat vil efterhånden blive opløst (under opladning) og deltage i lade/afladeprocessen igen.
Systemet blev opfundet i 1976 (patentet er fra 15. juni 1976) og flere firmaer fremstiller uafhængigt af hinanden kredsløb, der sender pulser på 3.26MHz gennem batteriet. De 3.26MHz skulle netop svare til sulfatkrystallets egenresonnans så krystallerne går i svingninger og bliver ødelagt.
I praksis gives der en kraftig kortvarig impuls adskillige gange i sekundet. Princippet er som at slå på en klokke. Et kort slag får klokken til at ringe med sin egenresonnans. På samme måde skal impulsen være væsentligt kortere end 1/3260000 sekund for at anslå sulfatkrystallerne.
De færdige impulsgivere koster omkring 400kr pr. batteri, men kan bygges for under 50. Se eventuelt mere her.
Der er stadig tvivl om metodens effektivitet.
Endelig er der den effektive men langsomme metode:
Ved let sulfatering holdes spændingen på 43.2V (umiddelbart under gasningsspændingen) i 2-5 dage. Herefter en afladning til 50% og så forfra igen.
Behandlingen foretages to-tre gange.
Hvis dette ikke er nok
Kraftig sulfatering. Dette kræver at batterierne behandles enkeltvis
Fjern syren og erstat med destilleret vand. Sulfaten opløses lettere i vand end i syre. Lad batteriet stå en time. Oplad så med 13.8V og max. 4A indtil maksimal massefylde af syren (svf=syrevægtfylde) er nået. Hvis værdien når op over 1.300g/cm3, hældes indholdet ud og erstattes med destilleret vand igen hvorefter processen gentages.
I modsat fald fjernes den dannede syre og cellerne skylles med destilleret vand, hvorefter frisk syre påfyldes.
Desværre fungerer medtoden ikke på alle batterier.
Ingen af metoderne giver ubegrænset levetid på batterierne. Elektrodestrukturen bliver stadig ødelagt af afladningen og den samme struktur (overflade) kan ikke forventes gendannet under opladning.
Det er en udbredt misforståelse, at batterierne ind imellem skal aflades helt og derefter lades op igen. Ideen kommer formodentlig fra NiCd batterier, der uretmæssigt er kendt for at have en 'memory effect'. Uretmæssigt, fordi manglende kapacitet hos NiCd batterier overvejende skyldes overopladning af batterierne.
Her kan en total afladning have god effekt, men ved blybatterier er det kun øget slid.
 |  | |
Ny elektrode | Sulfateret elektrode |
Batteriets levetid
Intet holder evigt og selv ved optimal vedligeholdelse gælder det også for batterierne. Kurven her viser sammenhæng mellem afladningsdybde (DoD) og antal opladninger.
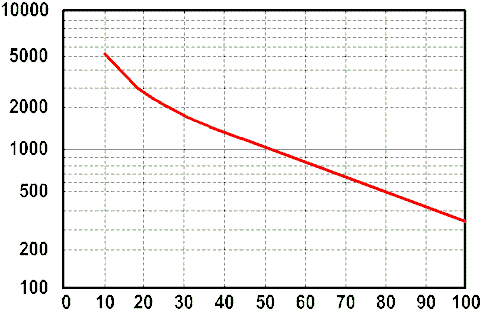
Heraf fremgår det at et perfekt vedligeholdt batteri holder til ca. 1000 50% afladning eller ca. 350 100% afladninger. Det ses tydeligt, at der vindes meget ved eksempelvis at bruge 30% ved at køre til arbejde, lade og bruge 30% på at køre hjem, fremfor ikke at lade mellem de to kørestrækninger. Samtidig vil batteriet - hvis der ikke oplades efter 30% forbrug - sulfatere, da restkapaciteten er under 80%.